Quand la biopsie cutanée peut étiqueter une épilepsie
Taoufiq Harmouch, Salim Gallouj, Kaoutar Znati, Aicha Slassi Sennou, Faouzi Belahcen, Afaf Amarti
Corresponding author: Taoufiq Harmouch, Laboratoire d’Anatomie Pathologique, CHU Hassan II, 79 Lot Dayaa, Hay Tghat, Fès, Maroc 
Received: 13 May 2011 - Accepted: 19 Sep 2011 - Published: 22 Oct 2011
Domain: Clinical medicine
Keywords: Lafora, épilepsie, biopsie cutanée, Maroc
©Taoufiq Harmouch et al. Pan African Medical Journal (ISSN: 1937-8688). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Taoufiq Harmouch et al. Quand la biopsie cutanée peut étiqueter une épilepsie. Pan African Medical Journal. 2011;10:26. [doi: 10.11604/pamj.2011.10.26.840]
Available online at: https://www.panafrican-med-journal.com//content/article/10/26/full
Quand la biopsie cutanée peut étiqueter une épilepsie
Taoufiq Harmouch1,&, Salim Gallouj2, Kaoutar Znati1, Aicha Slassi Sennou3, Faouzi Belahcen3, Afaf Amarti1
1Laboratoire d’Anatomie Pathologique, CHU Hassan II, Fès, Maroc, 2Service de Dermatologie, CHU Hassan II. Fès, Maroc, 3Service de Neurologie, CHU Hassan II, Fès, Maroc
&Auteur correspondant
Taoufiq Harmouch, Laboratoire d’Anatomie Pathologique, CHU Hassan II, 79 Lot Dayaa, Hay Tghat, Fès, Maroc
La maladie de Lafora est une maladie génétique autosomique récessive rare qui se manifeste par des épilepsies myocloniques progressives (EMP). Le diagnostic est évoqué devant l’association chez un adolescent d’une épilepsie avec des myoclonies et la détérioration cognitive progressive. Les anomalies à l’électroencéphalogramme sont caractéristiques et la confirmation est apportée par l’examen histologique par la présence de corps de Lafora au niveau des glandes sudoripares axillaires [1]. L’évolution est souvent fatale. Nous rapportons le cas d’une adolescente de 16 ans, issue de parents consanguins de premier degré, qui présente depuis l’âge de 14 ans des crises d’épilepsie et des myoclonies.
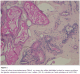
Patiente de 16 ans issue de parents consanguins de premier degré. Deux sœurs décédées par la même symptomatologie. Le début remonte à l’âge de 14 ans par l’apparition de crises généralisées tonico-cloniques et myocloniques dans un contexte de détérioration cognitive progressive. L’examen neurologique retrouve Syndrome cérébelleux cinétique. L’électroencéphalogramme (EEG) est en faveur d’une encéphalopathie épileptique. L’étude du LCR et le reste du bilan biologique sont normaux. L’imagerie par résonance magnétique (IRM) cérébrale a montré une Atrophie cérébrale. L’étude anatomopathologique de la biopsie cutanée effectuée au niveau de la région axillaire montre la présence de corps de Lafora au niveau des cellules épithéliales des glandes sudoripares apocrines. Ces corps de Lafora sont mieux visibles sur des coupes histologiques colorées par l’acide périodique de Schiff (PAS) (Figure 1). Ces données histologiques ont permis de confirmer le diagnostic de maladie de Lafora.
La maladie de Lafora (ML) est une forme particulièrement grave de l’EMP. La ML étant ubiquitaire, mais plus fréquente dans le pourtour méditerranéen [1]. Ses premières manifestations surviennent à l’adolescence: crises généralisées tonico-clonique ou clono-tonico-cloniques, myoclonus d’action et de repos, myoclonies négatives, mais aussi des crises partielles occipitales avec amaurose transitoire [2]. La ML est une maladie génétique autosomique récessive. Les études génétiques ont mis en évidence des variantes cliniques de la ML, et leur spectre devrait s’agrandir au fur et à mesure des progrès de l’élucidation des mécanismes génétiques. Il a par exemple été montré que les mutations dans l’exon 1 du gène EPM2A pouvaient produire un phénotype différent, avec début dans l’enfance parfois par des difficultés d’apprentissage, qui ne sont suivies que plus tard par l’évolution plus classique de la maladie [3]. Cette notion d’intervalle libre représente un élément important du diagnostic, comme cela fut le cas pour notre patiente. De même, le gène EMP2B semble être associé à une évolution un peu plus longue, et un peu moins sévère, de la ML et ceci indépendamment du type de mutation ou microdélétion constaté [4].
L’électroencéphalogramme (EEG), dont les modifications peuvent précéder l’installation des symptômes, met initialement en évidence une activité de fond normal e, parfois ralentie. Dans la moitié des cas il existe une activité diffuse de polypoints-ondes qui sont sporadiques ou en salves, spontanées ou provoquées par un mouvement ou par la marche, associées à un ralentissement progressif du rythme de fond et qui se majorent au fil du temps [1]. L’EEG réalisé à notre patiente a retrouvé des signes en faveur d’une encéphalopathie épileptique. A coté de la présentation typique de la maladie, qui s’applique à la grande majorité des cas, il existe des variantes notables qui nécessitent une confirmation histologique ou moléculaire.
Le rôle de la biopsie cutanée prélevée au niveau du creux axillaire est de confirmer le diagnostic de la ML en mettant en évidence des corps de Lafora ou de polyglucosan dans le cytoplasme des cellules épithéliales qui bordent les canaux excréteurs des glandes sudoripares apocrines. Ces inclusions PAS positifs caractéristique de la la maladie de Lafora sont présentes dans plusieurs organes comme le cerveau, le cœur, le foie et le muscle strié squelettique [2]. Les corps de Lafora sont des polyglycosans denses et phosphorylés, qui ressemblent à ceux des corps amylacés normaux constatés dans le cerveau des personnes âgées, mais leur localisation dans le péricaryon du neurone et dans les dendrites est caractéristique de la ML, car les polyglycosans physiologiques sont constatés le plus souvent au niveau des axones et des cellules gliales. La présence des corps de Lafora dans la biopsie axillaire chez des sujets jeunes est pathognomonique de la ML. Il faut cependant savoir que ces anomalies caractéristiques peuvent échapper à un œil peu exercé, et qu’une seconde lecture, ou une nouvelle biopsie axillaire, peuvent être nécessaires [2,5].
Les diagnostics différentiels sont discutés en fonction des du stade évolutif de la maladie. A un stade de début une épilepsie myoclonique juvénile ou autres formes idiopathiques sont évoqués. A la phase d’état le principal diagnostic différentiel est celui de la maladie d’Unverricht-Lundborg, alors qu’à la phase tardive de la ML toutes les étiologies d’EMP sont envisageables [6].
En l’absence de traitement curatif, la pharmaco-résistance et le ralentissement psychomoteur sont des facteurs limitant, et le décès survient 2 à 10 ans après le début de la symptomatologie, d’un mal épileptique et dans un état cachectique [1,4].
La maladie de Lafora appartient au groupe des épilepsies myocloniques progressives. Toutefois, elle possède des caractéristiques cliniques et évolutives notables. La résistance aux antiépileptiques et la détérioration cognitive progressive doivent orienter le clinicien vers la réalisation d’une biopsie cutanée axillaire à la recherche de corps de Lafora caractéristique de la maladie. Une étude moléculaire à la recherche de mutations géniques peut étayer le diagnostic et servir de base pour un conseil génétique. Son pronostic est constamment fatal.
Les auteurs déclarent n’avoir aucun conflit d’intérêt.
Tous les auteurs ont contribué à la prise en charge diagnostique et thérapeutique de la patiente et à la rédaction de ce cas clinique.
Figure 1: Corps de Lafora intracytoplasmiques (flèche) au niveau des cellules épithéliales bordant les canaux excréteurs des glandes sudoripares apocrines du creux axillaire. (GX 40, coloration par l’acide périodique de Schiff: PAS)
- Béjo Y et col. Épilepsie myoclonique progressive révélant une maladie de Lafora. Rev Neurol (Paris). Rev Neurol (Paris). 2007 Oct;163(10):975-8. This article on PubMed
- Darius Karimipour, Lori Lowe, Mila Blaivas, Dana Sachs, Timothy M Johnson. Lafora disease: Diagnosis by skin biopsy. J Am Acad Dermatol. 1999;41(5):790-792. This article on PubMed
- Ganesh S and al. Mutation screening for Japanese Lafora’s disease patients: identification of novel sequence variants in the coding and upstream regulatory regions of EPM2A gene. Mol Cell Probes. 2001 ;15(5):281-9. This article on PubMed
- Genton P. La maladie de Lafora (EPM2). Rev Neurol (Paris). 2007 Jan;163(1):47-53. This article on PubMed
- Girard J , Diep Le K H, Lederer F. Molecular characterization of laforin, a dual-specificity protein phosphatase implicated in Lafora disease. Biochimie. 2006 ;88(12):1961-71. This article on PubMed
- Matthew S Gentry, Jack E Dixon and Carolyn A Worby. Lafora disease : insights into neurodegeneration from plant metabolism. Trends Biochem Sci. 2009; 34 (12):628-639. This article on PubMed